Peut-on manger la consoude ?
Aymeric de Kerimel
La consoude Symphytum officinale est une plante de la famille des Boraginacées. Le genre Symphytum comporte environ 35 espèces dont 6 en France métropolitaine. La consoude présente une répartition européenne et centre-asiatique [1]. Elle pousse sur des sols humides au moins l’hiver et riches en matières organiques se décomposant mal [2], [3].
Pour tout ce qui suit, sauf précision, le terme « consoude » désignera l’espèce Symphytum officinale.
Quelques noms courants de la consoude : consoude commune, consoude officinale, consyre, grande consoude, grande consyre, herbe aux charpentiers, herbe aux coupures, langue de vache, oreille d’âne, oreille de vache, pecton [4], [5]. En anglais : comfrey, ass ear, black root, black wort, boneset, bruisewort, consound, gum plant, healing herb, knitback, knitbone, nipbone, salsify, slippery root, wallwort [6]–[8].
Le nom « consoude » vient du latin « consolida » : consolider, réparer ; le grec « symphytum », de « symphyeïn », veut dire la même chose et était donné à de nombreuses plantes [5], [9].
En agriculture, la consoude peut être utilisée comme purin (ou extrait fermenté) pour traiter une carence en potasse d’une plante, stimuler la croissance des feuilles, la vie du sol et la décomposition du compost [10].
Confusions
La confusion peut se faire avec la digitale pourpre (Digitalis purpurea) dont l’odeur est différente et la feuille est crénelée, moins pointue et moins rugueuse [2]. Cette confusion a déjà donné des cas mortels [11].
La molène bouillon noir (Verbascum nigrum) peut également se confondre avec la consoude ; la première a des feuilles crénelées, moins rugueuses et à odeur différente de celles de la consoude [2].
La consoude de Russie (Symphytum x uplandicum) se différencie de la consoude officinale par ses tiges non ailées et son toucher plus piquant [2]. La consoude de Russie est plus toxique mais aussi plus rare que la consoude officinale [1], [12].


Propriétés médicinales
La consoude est connue comme comestible et médicinale depuis au moins deux mille ans [5], [9].
Au Ier et IIème siècles : cicatrisant de la peau et osseux, contre les crachements de sangs et les hémorroïdes [5], [9].
Au XVIème siècle : cicatrisant de la peau et osseux, contre les maladies pulmonaires [5], [9].
Au XIXème siècle : adoucissant, astringent, contre la toux [13].
Au XXème siècle : adoucissant, astringent, cicatrisant de la peau [4], [9].
Autrefois, pour soulager les gerçures des seins, on creusait un petit trou dans la racine de consoude pour y introduire le mamelon [13].
Aujourd’hui on reconnaît à la consoude les propriétés d’anti-inflammatoire, de cicatrisant et d’immunomodulateur (active le système immunitaire), elle peut être utilisée en externe contre les douleurs et les inflammations des muscles et des articulations, les entorses, les foulures et les contusions [6], [14]–[17].
Composition
Sèche, elle contient notamment 0,6 à 4,7% d’allantoïne, 15 à 35% de protéines dans les feuilles, entre 15 et 30% de polysaccharides mucilagineux, entre 4 et 6% de tanins, environ 25% d’amidon, 0,04% de sodium, 0,2 à 0,4% de phosphore, 6 à 7% de potassium, 0,22% de soufre, 1,7 à 1,9% de calcium, 0,4% de magnésium, 15 à 17 ppm (partie par million, 1 ppm = 0,0001%) de cuivre, 0,05 à 0,4% de fer, 57 ppm de manganèse, 49 ppm de zinc, 0,4% d’azote, du molybdène, du sélénium, entre 1 et 3% d’asparagine, 1,2% d’alanine, 0,9% d’arginine, 2,1% de glutamine, 1% de glycine, 0,3% d’histidine, 0,8% d’isoleucine, 1,1% de leucine, 0,6% de lysine, 0,9% de proline, 0,8% de phénylalanine, 0,8% de sérine, 0,8% de thréonine, 0,6% de tyrosine, 1,1% de valine, des acides phénoliques, des glycopeptides, des saponines triterpènes, des vitamines antioxydantes, de la vitamine B12, de la consolidine, de la consolicine, de la symphytocynoglossine et des alcaloïdes pyrrolizidiniques ; fraîche, la consoude contient entre 82 et 92% d’eau [14], [15], [18]–[22].
Dans les années 1950, la consoude était cultivée au Canada et produisait de 20 à 32 t/ha [20]. La culture de consoude donne des récoltes de 5 à 32 t/ha [20]–[22]. En poids sec cela correspond à 0,6 à 4,2 t/ha.
Toxicité
Depuis une cinquantaine d’années, on reconnaît des effets néfastes à la consoude qui sont dus à un groupe de molécules présentes dans la plante et qu’on appelle les alcaloïdes pyrrolizidiniques (noté par la suite AP). Les effets peuvent être les suivants : hépatotoxique, cancérogène, génotoxique, tératogénique, pneumotoxique et abortif [23]–[25]. Les enfants jusqu’à 14 ans sont plus sensibles aux effets toxiques des AP que les adultes mais le pronostic de ces derniers lorsqu’ils sont atteints est plus mauvais [12].
On connaît environ 660 AP [26] dont environ 350 sont potentiellement toxiques et seulement une trentaine a fait l’objet d’étude sur leur toxicité individuelle [27]. La composition et la concentration des AP dans une plante peuvent varier selon les conditions environnementales (climat, sol, saison, etc.), l’âge et la partie de plante sélectionnée [28]. Il est probable que les racines soient plus riches en AP le soir et en lune montante et que les feuilles soient plus riches en AP le matin et en lune descendante. On suppose également que la consoude est moins riche en AP juste après la floraison et lorsque ses fleurs sont blanches [29]. Ces substances sont amères ce qui limite leur forte consommation en une seule prise [28], [30]. Les AP, récupérées par certains insectes, sont utilisés pour la défense contre les prédateurs [31]. Certaines plantes peuvent obtenir leurs AP via un parasitisme racinaire sur des plantes qui en produisent [32], [33]. Voici une liste non exhaustive des familles, genres ou espèces contenant des AP :
- toute la famille des Boraginacées;
- dans la famille des Astéracées, les genres Adenostyles, Ageratum, Brachyglottis, Cacalia, Cherdosoma, Chromolaena, Cineraria, Conoclinium, Crassocephalum, Doronicum, Echinacea, Emilia, Erechtites, Eupatorium, Farfagium, Gynura, Homogyne, Jacmaia, Jacobaea, Kleinia, Liatris, Ligularia, Nardosmia, Notonia, Odontocline, Packera, Petasites, Senecio, Solanecio, Syneilesis, Trichodesma, Tussilago et Werneria
- dans la famille des Fabacées, les genres Cassia, Crotalaria, Cytisus, Laburnum et Lotononis
- dans la famille des Apocynacées, les genres Alafia, Anodendron, Fernaldia, Holarrhena, Prestonia et Parsonsia
- une ou plusieurs espèces des familles suivantes : Centroplacacées (genre Bhesa), Poacées (genres Festuca, Lolium et Thelepogon), Orchidacées (genres Chysis, Hammarbya, Malaxis, Phalaenopsis, Liparis, Vanda et Vandopsis), Orobanchacées (genre Melampyrum), Renonculacées (genre Caltha), Rhizophoracées (genre Cassipourea), Santalacées (genre Thesium), Sapotacées (genres Mimusops et Planchonella), Scrofulariacées (genres Castilleja et Pedicularis) [26], [32]–[44]
Tous les AP ne sont pas toxiques, on considère qu’environ la moitié des AP sont toxiques [39]. Les AP ne passent que très peu au travers de la peau, le taux de pénétration en 24 h variant entre 0,04 et 0,22% des AP appliqués [45]. Ainsi l’application cutanée d’herbes médicinales contenant des AP comme la consoude est relativement sans danger. En revanche, les AP sont facilement solubles dans l’eau et l’alcool [46].
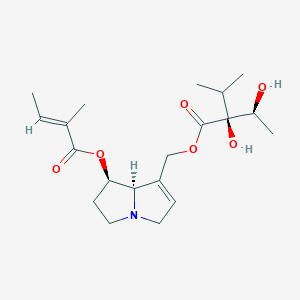
Pour ceux qui sont à l’aise en chimie voici les propriétés chimiques des AP toxiques : insaturation en C2 ; estérification en C7 (monoesters) avec groupe hydroxyle en C9 ou estérification en C7 et C9 (diesters, plus toxiques) sur une base libre ou N-oxyde ; les plus toxiques sont les AP diesters macro-cycliques [47]–[50] ; et voici deux AP parmi les plus représentés dans la consoude :

A partir des données de plusieurs études [50]–[53], on peut classer quelques AP en trois groupes par ordre de toxicité :
1) senkirkine, lasiocarpine, monocrotaline, riddelliine, héliotrine, sénécionine, sénéciphylline, acétylintermédine, héliosupine
2) riddelliine N-oxyde, sénécionine N-oxyde, lasiocarpine N-oxyde, lycopsamine, intermédine, indicine, symlandine, jacoline, symphytine, acétyllycopsamine, rétrorsine, latifoline
3) échimidine, indicine N-oxyde, supinine
La consoude contiendrait les AP suivant : acétylintermédine [12], [41], [50], [54], acétyllycopsamine [12], [18], [41], [48], [50], [54], échimidine [12], [18], [48], [55], [56], héliosupine [48], intermédine [12], [41], [50], [54], lasiocarpine [57], [58], lycopsamine [12], [41], [48], [50], [54], [59], myoscorpine [41], symlandine [12], [41], [48], [50], [55], symphytine [12], [18], [41], [48], [50], [54], [55] et symviridine [12], [41]. Tous sont toxiques. Par rapport au peu d’études rapportant certains AP dans celle-ci, il est probable que la consoude ne contienne pas d’héliosupine, de myoscorpine et de symviridine. D’après certaines études, l’échimidine, la lasiocarpine et la symlandine ne sont pas présentes dans la consoude [15], [59], [60].
D’après une étude, les AP les plus représentés dans la racine de consoude sont la symphytine et la symlandine [48]. D’après d’autres études les AP les plus représentés dans la consoude sont l’acétylintermédine et l’acétyllycopsamine [50], [54]. Une autre étude encore donne l’intermédine et la lycopsamine comme étant les AP les plus représentés dans la consoude [61].
La quantité d’AP varie aussi selon l’âge et la taille des feuilles : une étude donne 0,0003% de AP dans les grandes feuilles, 0,0016% dans les feuilles jusqu’à 15 cm de longueur et 0,0087% dans les jeunes feuilles jusqu’à 5 cm, soit 29 fois plus que dans les grandes [12]. Une autre étude confirme que les jeunes et petites feuilles contiennent plus d’AP que les vieilles et grandes feuilles [20]. Pour une espèce voisine, la consoude de Russie (Symphytum x uplandicum), on trouve 16 fois plus d’AP dans les petites et jeunes feuilles de début de saison (0,049%) que dans les grandes et vieilles feuilles (0,003%) [62].
La consoude contient 0,003% de lycopsamine [59]. Des feuilles de consoude vendues pour la préparation d’infusions contiennent 0,01% de symphytine [56]. La racine de consoude contient 4 fois plus de lycopsamine et d’intermédine, 8 fois plus d’acétyllycopsamine et 11 fois plus d’acétylintermédine que les feuilles [63].
Les formes commercialisées de consoude contiennent entre 0,0007 et 0,83% d’AP [12], [48], [54]. Ces formes commercialisées sont souvent polluées par d’autres espèces de consoudes comme la consoude de Russie (Symphytum x uplandicum) qui peuvent les rendre plus dangereuses [12].
Tous AP confondus, la consoude contiendrait de 0,02 à 0,18% d’AP dans ses feuilles, 0,25 à 0,29% dans ses racines et une quantité indéterminée dans les fleurs [24], [41]. Selon une autre étude la racine de consoude contient entre 0,14 et 0,83% d’AP, et les feuilles entre 0,0015 et 0,0055% d’AP [48]. D’après une autre étude encore, sur 300 échantillons, les racines de consoude venant de 150 sites différents contiennent entre 0,045 et 0,599% d’AP [12]. Une dernière étude donne des concentrations d’AP dans la consoude entre 0,04 et 0,6% [19]. Au total on peut considérer que la racine de consoude contient entre 0,045 et 0,83% d’AP et que les feuilles en contiennent entre 0,0003 et 0,18%. En moyenne des différentes études on obtient : 0,36% dans les racines et 0,05% dans les feuilles, 8 fois plus dans les racines que dans les feuilles. On peut également estimer qu’en moyenne les jeunes feuilles contiennent 0,09% d’AP et les vieilles feuilles 0,004%.
La toxicité de la racine de consoude est supérieure à la toxicité cumulée de ses AP [61]. Ceci est probablement vrai également pour les feuilles.
Des recommandations existent en matière de quantités d’AP à ne pas dépasser dans la consommation [39], [43], [64] :
- L’ « Australian New Zealand Food Authority » considère que 10 µg AP/kg/jour est une dose sans effet, que le risque de cancer est négligeable et que donc, en prenant une marge de sécurité, il ne faut pas dépasser la dose de 1 µg AP/kg/jour, c’est-à-dire qu’une personne de 60 kg ne devrait pas dépasser la dose de 60 µg AP/jour.
- Aux Pays-Bas, on considère que 10 µg AP/kg/jour est une dose sans effet autre que les cancers. Avec la marge de sécurité, la dose à ne pas dépasser pour éviter les effets autres que les cancers est de 0,1 µg AP/kg/jour. La dose à ne pas dépasser pour éviter les cancers dus aux AP est de 0,00043 µg AP/kg/jour, basé sur un effet cancérigène connu à 1000 µg/kg/jour.
- Au Royaume-Uni, le « Committee on Toxicity » considère que 10 µg AP/kg/jour est une dose sans effet autre que les cancers. Avec la marge de sécurité, leur recommandation pour éviter les effets autres que les cancers est de ne pas dépasser la dose de 0,1 µg équivalent riddelliine/kg/jour. Par rapport aux AP présents dans la consoude, cela correspond environ à 1,88 µg/kg/jour pour l’intermédine et la lycopsamine, 0,1 µg/kg/jour pour la lasiocarpine, 0,25 µg/kg/jour pour l’échimidine et 0,38 µg/kg/jour pour la symphytine. Leur recommandation pour éviter les cancers dus aux AP est de ne pas dépasser la dose de 0,007 µg AP/kg/jour, basé sur un effet cancérigène connu à 73 µg/kg/jour.
- En Allemagne, la consommation maximale d’AP par les médicaments est de 0,1 µg AP/jour ou 1 µg AP/jour 6 semaines par an. La préconisation pour ne pas avoir d’effet cancérigène est de ne pas dépasser la dose de 0,007 µg/kg pour les AP toxiques.
- L’Organisation Mondiale de la Santé recommande de limiter au maximum la consommation d’AP.
La consoude est interdite à la vente en Australie, au Japon, en Afrique du Sud et au Royaume-Uni [43].
A partir des recommandations ci-dessus et des moyennes de concentration d’AP dans les racines et feuilles de consoude calculées précédemment, on peut dire que la dose de 1 µg AP/kg/jour correspond à 16,5 mg de feuilles de consoude fraîche/kg/jour soit 0,99 g/jour pour une personne de 60 kg ; pour les racines cela correspond à 0,13 g/jour. En ce qui concerne la recommandation plus restrictive de 0,007 µg/kg/jour préconisée au Royaume-Uni et en Allemagne, cela correspond à 7 mg/jour pour les feuilles de consoude pour une personne de 60 kg et 0,9 mg/jour pour les racines.
Pour comprendre à quelle quantité de feuilles entières et fraîches ces valeurs correspondent, nous avons pesé 451 feuilles de consoude à l’aide d’une balance précise au centième, nous avons également mesurés ces feuilles par tranches de 5 cm (longueur du limbe foliaire). Le poids moyen d’une feuille de consoude est donc de 6,8 g. Le poids moyen des feuilles de plus de 25 cm est 9,1 g. Le poids moyen des feuilles de moins de 15 cm est 1,16 g.
La recommandation de 1 µg AP/kg/jour correspond donc environ à 1 feuille de consoude tous les 7 jours pour une personne de 60 kg (ou 1 vieille grande feuille par jour). La recommandation de 0,007 µg AP/kg/jour correspond à environ 1 feuille de consoude tous les 974 jours pour une personne de 60 kg (ou 1 vieille grande feuille tous les 115 jours).
Il existe quelques facteurs aggravant lors de la prise d’AP, c’est le cas de l’alcool dont les effets toxiques pour le foie se trouvent renforcés par la présence des AP [65]. Le manque de protéines et d’acides aminés soufrés dans la consommation sont aussi des facteurs de risque [14], [37], [66].
Cas d’intoxications
Beaucoup d’intoxications humaines aux AP sont connues. Il s’agit souvent de « pollutions » de graines de céréales par des graines de certaines espèces des genres Senecio et Crotalaria [24]. Par exemple le cas rapporté en 1976 en Afghanistan où des milliers de personnes ont montré des signes de lésions du foie par la consommation de pain fait à partir de céréales contaminées par des graines de plantes du genre Heliotropium [67]. Plus récemment en Allemagne où des feuilles de sénéçons (genre Senecio) se sont retrouvées dans des sachets de salades vendues en supermarchés [23]. Des intoxications sont parfois dues à des confusions avec certaines plantes médicinales. Par exemple un cas aux Etats-Unis avec la confusion entre Senecio longilobus toxique et un Gnaphalium [24]. Un dernier type d’intoxication directe est dû à l’utilisation comme plante médicinale ou alimentaire d’une plante contenant des AP. C’est ce dernier cas qui concerne la consoude et même des sénéçons (genre Senecio) [24]. Il est probable que les effets cancérogènes de la consoude soient moins importants que ceux du tussilage (Tussilago farfara) et des pétasites (Petasites sp.) [57].
Il existe aussi une intoxication indirecte aux AP par le biais de produits d’animaux qui ont consommés des AP. Le miel, le pollen, le lait, les œufs, la viande et tous les produits transformés qui utilisent ces premiers produits peuvent contenir des AP [30], [68]–[71]. Des intoxications, et même des cas mortels, ont eu lieu par la transmission de AP par le lait d’allaitement ou via le placenta chez des fétus et nouveau-nés animaux ou humains [72]–[74]. En France, les principales sources d’AP dans le miel sont les sénéçons (genres Jacobaea et Senecio), l’eupatoire chanvrine (Eupatorium cannabinum) et les vipérines (genre Echium). En Europe, les plantes qui apportent le plus d’AP au miel sont les vipérines (genre Echium) [75].
Des vaches nourries 2 semaines avec 10 g/kg/jour de sénéçon (Jacobaea vulgaris) sec, correspondant à 16 mg/kg/jour d’AP, produisent du lait contenant entre 0,094 et 0,167 mg AP/L de lait [69]. Une personne de 60 kg qui boit 500 mL de ce lait ingère environ 1 µg AP/kg. Avec ce lait, il suffirait de 3 mL/jour pour une personne de 60 kg pour arriver à la dose de 0,007 µg AP/kg/jour.
En ce qui concerne le miel on trouve différentes concentrations d’AP : aux Etats-Unis, de 0,3 à 3,9 mg AP/kg pour du miel contenant de 0,3 à 3,3% de pollen de sénéçon (Jacobaea vulgaris) [71] ; en Australie, de 0,27 à 0,95 mg AP/kg pour du miel de vipérine (Echium plantagineum) [68]. Une étude sur 3917 échantillons de miels venant de nombreux pays montrent qu’en Europe les miels allemands, hongrois, bulgares et roumains contient moins d’AP que les miels espagnols et italiens, et que les miels d’Amérique du sud et centrale contiennent en moyenne le plus d’AP [75]. Sur les 696 miels raffinés provenant d’Europe de cette étude, la concentration moyenne en AP était de 25 µg AP/kg; sur les 381 miels bruts provenant d’Europe, la concentration moyenne en AP était de 17 µg AP/kg; sur 119 échantillons de pollens commercialisés, la concentration moyenne en AP était de 1108 µg AP/kg [75]. Dans une autre étude, sur 13280 miels bruts, la concentration moyenne en AP est entre 28 et 36 µg AP/kg ; sur 1324 miels raffinés, la concentration moyenne en AP est entre 13 et 26 µg AP/kg [64]. D’après ces deux dernières études, une personne de 60 kg ne devrait pas dépasser la consommation journalière d’environ 17 g de miel et de 0,38 g de pollen pour ne pas dépasser la dose de 0,007 µg AP/kg/jour.
Une dernière étude avec d’autres méthodes d’analyses réalisée sur 55 échantillons de miels venant d’Europe a montré que 17 échantillons contenaient entre 1,08 et 16,35 mg AP/kg de miel, cette même étude donne aussi 500 à 5000 mg AP/kg de pollen [35]. D’après cette étude et avec la recommandation de 0,007 µg AP/kg/jour, une personne de 60 kg ne devrait pas dépasser la consommation journalière d’environ 60 mg de miel et d’environ 0,2 mg de pollen.
Les animaux évitant les plantes les plus dangereuses à l’état frais, la présence d’AP dans le lait passe généralement par le fourrage des animaux élevés de manière industrielle, les animaux sauvages ou élevés à l’herbe peuvent trier les espèces ne contenant pas ou peu d’AP et même, pour une espèce contenant des AP, sélectionner seulement les individus qu’on suppose les moins riches en AP et seulement à certaines périodes. C’est le cas pour les chevaux qui ne mangent la consoude qu’après la floraison et uniquement les consoudes à fleurs blanches (morphotype) [29]. Les animaux ayant très faim peuvent se résoudre à manger des plantes toxiques qu’ils refusent généralement [27]. C’est souvent les séneçons (genre Senecio) qui sont alors impliqués dans les dommages.
Les cas humains d’intoxications par la consoude sont rares ou en tous cas peu connus et répertoriés. Il est également difficile de déterminer l’origine des dommages qui peuvent être causés par la consoude. C’est donc, jusqu’à présent, 5 cas d’intoxication qui ont été clairement induits par la consommation de consoude mais l’espèce précise n’est pas connue.
Voici ces cas connus d’hospitalisation :
- Une femme de 49 ans, aux Etats-Unis, après 6 mois de consommation d’environ 15 µg AP/kg/jour, principalement sous forme de six capsules de poudre de consoude (Symphytum sp.) par jour [76].
- Un enfant de 13 ans, en Angleterre, souffrant de désordres digestifs, que les parents ont soigné avec de la racine de consoude (Symphytum sp.) [77].
- Une femme de 47 ans, ayant consommé 10 tasses d’infusion de consoude en plus de capsules de consoude (Symphytum sp.). Huit ans après l’hospitalisation le foie était encore atteint [24].
- Un homme de 23 ans, mort après avoir consommé pendant plusieurs mois une dose inconnue de consoude (Symphytum sp.) [24].
- Une femme de 66 ans, ayant consommé 1 à 1,5 L d’une infusion d’un mélange de plantes dont la consoude (Symphytum sp.) [78].
Tous AP confondus, les doses minimales où un effet néfaste a été identifié chez l’humain sont données par le tableau suivant :
|
Alcaloïdes pyrrolizidiniques |
Dose prise en mg/kg par jour |
Durée de la prise |
Dose cumulée en mg/kg |
Effets |
|
Héliotrine |
4-10 |
3 à 7 semaines |
84 à 490 |
Maladie véno-occlusive hépatique, nécrose du foie [24] |
|
Crotanine et crotaburnine |
Moins de 1 |
Plusieurs mois |
|
Maladie véno-occlusive hépatique, nécrose du foie [24] |
|
Rétrorsine |
0,7-1,5 |
2 semaines |
9,8 à 21 |
Nécrose, fibrose et cirrhose du foie [24] |
|
Riddelliine |
0,7-1,5 |
2 semaines |
9,8 à 21 |
Nécrose, fibrose et cirrhose du foie [24] |
|
AP de Symphytum sp. |
Au moins 0,015 |
6 mois |
2,7 |
Congestion et nécrose du foie, oblitération des vénules hépatiques, hypertension [76] |
|
AP de Heliotropium popovii ssp. gallianum |
0,03-0,04 |
2 ans |
21,9 |
Maladies sévères du foie [67] |
|
AP de Adenostyles alliariae (dont senecipylline) |
0,06 |
15 mois |
27 |
Maladie véno-occlusive hépatique [79] |
|
AP d’une Astéracée inconnue |
26 |
45 jours |
1170 |
Douleurs abdominales, hypertrophie du foie [80] |
|
AP d’une Astéracée inconnue |
23 |
46 jours |
1058 |
Décès, insuffisance hépatique [80] |
|
AP d’une Astéracée inconnue |
12 |
19 jours |
228 |
Douleurs abdominales, hypertrophie du foie [80] |
|
AP d’une Astéracée inconnue |
15 |
21 jours |
315 |
Démangeaisons cutanées [80] |
|
AP d’origine inconnue |
9 à 18 |
14 jours |
126 à 252 |
Intoxication (enfant de 6 mois) [80] |
|
AP d’origine inconnue |
13 |
4 jours |
52 |
Décès (enfant de 2 mois) [80] |
|
Indicine N-oxyde |
280 |
Une seule prise |
280 |
Décès au bout de 9 jours (enfant de 5 ans) [81] |
En reprenant la seule étude du tableau ci-dessus qui concerne une consoude (Symphytum sp.) on s’aperçoit que les concentrations d’AP trouvées dans les capsules de consoude paraissent faibles. Une capsule de consoude (Symphytum sp.) contient environ 89% de consoude (Symphytum sp.) [82]. Les capsules de l’étude pesant 400 mg, si celles-ci ont été faites à partir de la consoude officinale, qui est la consoude communément utilisée contenant le moins d’AP [12], [19], la quantité d’AP par capsule aurait dû être d’environ 1,27 mg ; la quantité mesurée est de 0,13 mg (l’étude a été réalisée en 1985, les méthodes d’analyses se sont améliorées depuis). Ainsi la dose prise pourrait être de 92 µg AP/kg/jour au lieu de 15 µg AP/kg/jour, soit une dose cumulée de 16,6 mg/kg. Même en ayant revu à la hausse ces valeurs, elles restent faibles et douteuses car elles feraient de la consoude la plus toxique des plantes contenant des AP chez l’humain, ce qui est contradictoire avec l’extrême rareté des cas d’intoxications à la consoude comparativement à d’autres plantes dont la toxicité est connue de longue date.
Chez les animaux les effets des AP sont plus étudiés. Les poules et les cochons sont les plus sensibles au AP, suivent les vaches, les chevaux, les dindes et les rats qui sont eux-mêmes plus sensibles aux AP que les moutons, les chèvres, les lapins et les souris [12], [27], [30]. Les cobayes et les hamsters sont très résistants aux AP [12], [83], [84]. Il semblerait que les humains soient plus résistants que les rats [25] et autant que les souris [27].
Pour les AP contenus dans la consoude, les doses minimales d’effets néfastes chez les animaux sont données par le tableau suivant :
|
Alcaloïdes pyrrolizidiniques |
Dose |
Durée de la prise |
Dose cumulée en mg/kg |
Effet |
Animal |
|
Symphytine |
300 mg/kg |
une seule prise |
300 |
LD501 |
Rats [18] |
|
Echimidine |
200 mg/kg |
une seule prise |
200 |
LD50 |
Rats [85] |
|
Feuilles de consoude |
8% du régime alimentaire2 |
20 mois |
424 |
tumeur du foie |
Rats [57] |
|
Racines de consoude |
1% du régime alimentaire3 |
10 mois |
205 |
tumeur du foie |
Rats [57] |
|
Racines de consoude |
2% du régime alimentaire4 |
12 semaines |
115 |
mutations génétique du foie |
Rats [86] |
|
Lasiocarpine |
1,2 mg/kg/jour5 |
60 semaines |
504 |
tumeurs du foie et de la peau |
Rats [87] |
|
Lasiocarpine |
77 mg/kg |
une seule prise |
77 |
LD50 |
Rats [52] |
|
Intermédine et lycopsamine |
1 g/kg |
une seule prise |
1000 |
tumeurs du pancréas |
Rats [88] |
|
Acétyllycopsamine |
750 mg/kg |
une seule prise |
750 |
Inflammation du foie |
Souris [89] |
1 : létalité pour 50% des individus
2 : le rat moyen pèse 425 g et a une ration alimentaire moyenne de 19 g/jour [90], 8% représentent donc 1,5 g de feuilles/jour, cela correspond à environ 0,7 mg AP/kg/jour
3 : 1% représente 0,2 g de racines/jour, cela correspond à environ 0,7 mg AP/kg/jour
4 : 2% représentent 0,4 g de racines/jour, cela correspond à environ 1,4 mg AP/kg/jour
5 : 7,8 mg AP/kg 2 fois par semaine pendant 4 semaines puis 1 fois par semaine pendant 52 semaines
A partir du tableau ci-dessus on remarque que les effets de la lasiocarpine sont du même ordre de grandeur que ceux de la consoude, on peut ainsi estimer la LD50 de la consoude à 1,27 kg/kg, c’est-à-dire qu’une personne de 60 kg devrait manger environ 76,4 kg de consoude en une fois pour avoir 50% de chance de létalité immédiate. On remarque aussi qu’à la même concentration d’AP, les feuilles de consoudes sont 2 fois moins toxiques que les racines.
En conclusion
En reprenant les données du tableau ci-dessus et si l’on considère que les humains sont aussi sensibles que les rats (alors qu’ils le sont probablement davantage [25]), il ne faudrait donc pas atteindre la dose de 0,7 mg AP/kg/jour pour ne pas subir les effets néfastes des AP de la consoude, en prenant une marge de sécurité disons qu’il ne faudrait pas dépasser la dose de 0,07 mg AP/kg/jour. Cela correspond donc, pour une personne de 60 kg, à 69 g/jour de feuilles fraîches de consoude et 9 g/jour de racines. Cela correspond à environ 10 feuilles par jour pour une personne de 60 kg. Si l’on considère la différence entre les jeunes petites et les vieilles grandes feuilles, une personne de 60 kg ne devrait pas dépasser la dose de 35 g pour les jeunes feuilles (environ 30 feuilles par jour) et 787 g (environ 87 feuilles par jour) pour les vieilles feuilles. Pour encore plus de marge de sécurité, on pourrait encore diviser la dose par 10 et donc arriver à une dose à ne pas dépasser de 9 vieilles grandes feuilles par jour.
La consommation de consoude est à éviter chez les femmes enceintes et allaitantes.
Pour pouvoir confirmer les calculs et recommandations, d’autres études sur les quantités d’AP dans la consoude en fonction de divers facteurs environnementaux et sur la toxicité de la consoude seraient nécessaires.
Il ne faut pas oublier que l’Organisation Mondiale de la Santé recommande de limiter aux maximum la consommation d’AP, c’est-à-dire qu’elle recommande de ne pas consommer de consoude...
[1] J.-M. Tison et B. de Foucault, Flora gallica: flore de France. Biotope Mèze, 2014.
[2] J. Poland et al., The Vegetative Key to the British Flora. UK: Botanical Society of the British Isles, 2009.
[3] G. Ducerf, L’encyclopédie des plantes bio-indicatrices alimentaires et médicinales: guide de diagnostic des sols. Promonature, 2013.
[4] J. Valnet, Phytothérapie: se soigner par les plantes. Librairie générale française, 1983.
[5] P. Fournier et C. Boisvert, Dictionnaire des plantes médicinales et vénéneuses de France. Omnibus, 2010.
[6] S. E. Edwards, I. da C. Rocha, M. Heinrich, et E. M. Williamson, Phytopharmacy: An Evidence-Based Guide to Herbal Medicinal Products. John Wiley & Sons, 2015.
[7] PDR for Herbal Medicines. Medical Economics Company, 2000.
[8] R. C. Wren, Potter’s Cyclopedia of Botanical Drugs and Preparations. Potter & Clarke, 1950.
[9] P. Lieutaghi, Le livre des bonnes herbes, 3ème édition révisée. Actes Sud, 1996.
[10] E. Petiot, Les soins naturels aux arbres. Terran, 2008.
[11] I.-L. Wu, J.-H. Yu, C.-C. Lin, C.-J. Seak, K. R. Olson, et H.-Y. Chen, « Fatal cardiac glycoside poisoning due to mistaking foxglove for comfrey », Clin. Toxicol., vol. 0, no 0, p. 1‑4, mai 2017.
[12] A. Denham, « Using herbs that contain pyrrolizidine alkaloids », Eur J Herb. Med, vol. 2, p. 27‑38, 1996.
[13] F. J. Cazin, Traité pratique et raisonné des plantes médicinales indigènes: avec un atlas de 200 planches lithographiées. P. Asselin, 1868.
[14] D. Rode, « Comfrey toxicity revisited », Trends Pharmacol. Sci., vol. 23, no 11, p. 497‑499, nov. 2002.
[15] C. Staiger, « Comfrey: A Clinical Overview », Phytother. Res., vol. 26, no 10, p. 1441‑1448, oct. 2012.
[16] R. Frost, H. MacPherson, et S. O’Meara, « A critical scoping review of external uses of comfrey (Symphytum spp.) », Complement. Ther. Med., vol. 21, no 6, p. 724‑745, déc. 2013.
[17] J. Bruneton, Pharmacognosie, phytochimie, plantes médicinales (5e éd.). Lavoisier, 2016.
[18] T. Furuya et K. Araki, « Studies on Constituents of Crude Drugs. I. Alkaloids of Symphytum officinale LINN. », Chem. Pharm. Bull. (Tokyo), vol. 16, no 12, p. 2512‑2516, 1968.
[19] F. Stickel et H. K. Seitz, « The efficacy and safety of comfrey », Public Health Nutr., vol. 3, no 4A, p. 501‑508, déc. 2000.
[20] B. Barl, N. Gibson, B. Crerar, J. Shao, et S. Sokhansanj, « Feasibility of producing comfrey (Symphytum spp.) pellet as a feed supplement ».
[21] F. B. Bareeba, W. O. Odwongo, et J. S. (Makerer U. Mugerwa, « The potential of Russian comferey (Symphytum officinale) as an animal feedstuff in Uganda », présenté à Joint Feed Resources Network Workshop on the Complementarity of Feed Resources for Animal Production in Africa, Gaborone (Botswana), 4-8 Mar 1991, 1992.
[22] T. Teynor et al., « Comfrey », in Alternative Field Crops Manual, University of Wisconsin-Extension, Cooperative Extension, 1992.
[23] H. Wiedenfeld et J. Edgar, « Toxicity of pyrrolizidine alkaloids to humans and ruminants », Phytochem. Rev., vol. 10, no 1, p. 137‑151, mars 2011.
[24] S. Dharmananda, « Safety Issues Affecting Herbs: Pyrrolizidine Alkaloids », 2001. [En ligne]. Disponible sur: http://www.itmonline.org/arts/pas.htm. [Consulté le: 17-mai-2017].
[25] A. S. Prakash, T. N. Pereira, P. E. B. Reilly, et A. A. Seawright, « Pyrrolizidine alkaloids in human diet », Mutat. Res. Toxicol. Environ. Mutagen., vol. 443, no 1–2, p. 53‑67, juillet 1999.
[26] E. Roeder, « Medicinal plants in china containing pyrrolizidine alkaloids », Pharmazie, vol. 55, no 10, p. 711‑726, 2000.
[27] B. L. Stegelmeier, S. M. Colegate, et A. W. Brown, « Dehydropyrrolizidine Alkaloid Toxicity, Cytotoxicity, and Carcinogenicity », Toxins, vol. 8, no 12, p. 356, nov. 2016.
[28] L. A. P. Hoogenboom et al., « Carry-over of pyrrolizidine alkaloids from feed to milk in dairy cows », Food Addit. Contam. Part A, vol. 28, no 3, p. 359‑372, mars 2011.
[29] A.-J. Ghesquière, .
[30] E. Kowalczyk, E. Patyra, et K. Kwiatek, « Pyrrolizidine alkaloids as a threat to human and animal health. », Med. Weter., vol. 71, no 10, p. 602‑607, 2015.
[31] R. Lindigkeit, A. Biller, M. Buch, H.-M. Schiebel, M. Boppré, et T. Hartmann, « The two Faces of Pyrrolizidine Alkaloids: the Role of the Tertiary Amine and its N-Oxide in Chemical Defense of Insects with Acquired Plant Alkaloids », Eur. J. Biochem., vol. 245, no 3, p. 626‑636, mai 1997.
[32] E. W. Mead, M. Looker, D. R. Gardner, et F. R. Stermitz, « Pyrrolizidine alkaloids of Liatris punctata and its root parasite, Castilleja integra », Phytochemistry, vol. 31, no 9, p. 3255‑3257, sept. 1992.
[33] M. J. Schneider et F. R. Stermitz, « Uptake of host plant alkaloids by root parasitic Pedicularis species », Phytochemistry, vol. 29, no 6, p. 1811‑1814, janv. 1990.
[34] R. J. Huxtable, « Herbal teas and toxins: novel aspects of pyrrolizidine poisoning in the United States. », Perspect. Biol. Med., vol. 24, no 1, p. 1‑14, 1980.
[35] M. Kempf et al., « Pyrrolizidine alkaloids in pollen and pollen products », Mol. Nutr. Food Res., vol. 54, no 2, p. 292‑300, févr. 2010.
[36] S. N. Arseculeratne, A. A. L. Gunatilaka, et R. G. Panabokke, « Studies on medicinal plants of Sri Lanka: Occurrence of pyrrolizidine alkaloids and hepatotoxic properties in some traditional medicinal herbs », J. Ethnopharmacol., vol. 4, no 2, p. 159‑177, sept. 1981.
[37] R. Schoental, « Toxicology and carcinogenic action of pyrrolizidine alkaloids », Cancer Res., vol. 28, no 11, p. 2237‑2246, nov. 1968.
[38] E. Roeder et T. Bourauel, « Pyrrolizidine alkaloids from Melampyrum pratense », Nat. Toxins, vol. 1, no 1, p. 35‑37, janv. 1992.
[39] World Health Organization, International Programme on Chemical Safety, et WHO Task Group on Pyrrolizidine Alkaloids, « Pyrrolizidine alkaloids », 1988.
[40] R. A. Coulombe, « Pyrrolizidine alkaloids in foods », Adv. Food Nutr. Res., vol. 45, p. 61‑99, 2003.
[41] E. Roeder, « Medicinal plants in Europe containing pyrrolizidine alkaloids. », Pharm., vol. 50, no 2, p. 83‑98, févr. 1995.
[42] M. Omar, J. De Feo, et H. W. Youngken, « Chemical and Toxicity Studies of Trichodesma africanum L. », J. Nat. Prod., vol. 46, no 2, p. 153‑156, mars 1983.
[43] World Health Organization, « Discussion paper on pyrrolizidine alkaloids », Jt. FAOWHO Food Stand. Programme Codex Comm. Contam. Foods Hague Neth., 2011.
[44] Esco Working Group Members, « EFSA Compendium of botanicals that have been reported to contain toxic, addictive, psychotropic or other substances of concern », EFSA Support. Publ., vol. 6, no 6, p. n/a-n/a, sept. 2009.
[45] N. Jedlinszki, B. Balázs, E. Csányi, et D. Csupor, « Penetration of lycopsamine from a comfrey ointment through human epidermis », Regul. Toxicol. Pharmacol., vol. 83, p. 1‑4, février 2017.
[46] N. Mei, L. Guo, P. P. Fu, J. C. Fuscoe, Y. Luan, et T. Chen, « Metabolism, Genotoxicity, annd Carcinogenicity of Comfrey », J. Toxicol. Environ. Health Part B, vol. 13, no 7‑8, p. 509‑526, déc. 2010.
[47] E. K. McLEAN, « Senecio and other plants as liver poisons », Isr J Med Sci, vol. 10, p. 436‑440, 1974.
[48] C. E. Couet, C. Crews, et A. B. Hanley, « Analysis, separation, and bioassay of pyrrolizidine alkaloids from comfrey (Symphytum officinale) », Nat. Toxins, vol. 4, no 4, p. 163‑167, 1996.
[49] H.-Y. Kim, F. R. Stermitz, et R. A. Coulombe, « Pyrrolizidine alkaloid-induced DNA-protein cross-links », Carcinogenesis, vol. 16, no 11, p. 2691‑2697, nov. 1995.
[50] H. Frei, J. Lüthy, J. Brauchli, U. Zweifel, F. E. Würgler, et C. Schlatter, « Structure/activity relationships of the genotoxic potencies of sixteen pyrrolizidine alkaloids assayed for the induction of somatic mutation and recombination in wing cells of Drosophila melanogaster », Chem. Biol. Interact., vol. 83, no 1, p. 1‑22, juin 1992.
[51] A. Brown, « Relative Toxicity of Select Dehydropyrrolizidine Alkaloids and Evaluation of a Heterozygous P53 Knockout Mouse Model for Dehydropyrrolizidine Alkaloid Induced Carcinogenesis », Grad. Theses Diss., janv. 2015.
[52] R. A. Field, B. L. Stegelmeier, S. M. Colegate, A. W. Brown, et B. T. Green, « An in vitro comparison of the cytotoxic potential of selected dehydropyrrolizidine alkaloids and some N-oxides », Toxicon, vol. 97, p. 36‑45, avr. 2015.
[53] P. P. Fu, Q. Xia, G. Lin, et M. W. Chou, « Pyrrolizidine Alkaloids—Genotoxicity, Metabolism Enzymes, Metabolic Activation, and Mechanisms », Drug Metab. Rev., vol. 36, no 1, p. 1‑55, janv. 2004.
[54] J. Brauchli, J. Lüthy, U. Zweifel, et C. Schlatter, « Pyrrolizidine alkaloids fromSymphytum officinale L. and their percutaneous absorption in rats », Experientia, vol. 38, no 9, p. 1085‑1087, sept. 1982.
[55] N. C. Kim, N. H. Oberlies, D. R. Brine, R. W. Handy, M. C. Wani, et M. E. Wall, « Isolation of symlandine from the roots of common comfrey (Symphytum officinale) using countercurrent chromatography », J. Nat. Prod., vol. 64, no 2, p. 251‑253, févr. 2001.
[56] N. H. Oberlies et al., « Analysis of herbal teas made from the leaves of comfrey (Symphytum officinale): reduction of N-oxides results in order of magnitude increases in the measurable concentration of pyrrolizidine alkaloids », Public Health Nutr., vol. 7, no 7, p. 919‑924, oct. 2004.
[57] I. Hirono, H. Mori, et M. Haga, « Carcinogenic activity of Symphytum officinale », J. Natl. Cancer Inst., vol. 61, no 3, p. 865‑869, sept. 1978.
[58] B. T. Schaneberg, R. J. Molyneux, et I. A. Khan, « Evaporative light scattering detection of pyrrolizidine alkaloids », Phytochem. Anal., vol. 15, no 1, p. 36‑39, janv. 2004.
[59] F. Liu, S. Y. Wan, Z. Jiang, S. F. Y. Li, E. S. Ong, et J. C. C. Osorio, « Determination of pyrrolizidine alkaloids in comfrey by liquid chromatography–electrospray ionization mass spectrometry », Talanta, vol. 80, no 2, p. 916‑923, déc. 2009.
[60] H. J. Huizing, T. W. J. Gadella, et E. Kliphuis, « Chemotaxonomical investigations of theSymphytum officinale polyploid complex andS. asperum (Boraginaceae): The pyrrolizidine alkaloids », Plant Syst. Evol., vol. 140, no 4, p. 279‑292, sept. 1982.
[61] A. W. Brown et al., « The comparative toxicity of a reduced, crude comfrey (Symphytum officinale) alkaloid extract and the pure, comfrey-derived pyrrolizidine alkaloids, lycopsamine and intermedine in chicks (Gallus gallus domesticus) », J. Appl. Toxicol., vol. 36, no 5, p. 716‑725, mai 2016.
[62] A. R. Mattocks, « TOXIC PYRROLIZIDINE ALKALOIDS IN COMFREY », The Lancet, vol. 316, no 8204, p. 1136‑1137, nov. 1980.
[63] J. M. Betz, R. M. Eppley, W. C. Taylor, et D. Andrzejewski, « Determination of pyrrolizidine alkaloids in commercial comfrey products (Symphytum sp.) », J. Pharm. Sci., vol. 83, no 5, p. 649‑653, mai 1994.
[64] EFSA Panel on Contaminants in the Food Chain (CONTAM), « Scientific Opinion on Pyrrolizidine alkaloids in food and feed », EFSA J., vol. 9, no 11, p. 1‑134, 2011.
[65] M. G. Neuman, L. B. Cohen, et V. Steenkamp, « Pyrrolizidine alkaloids enhance alcohol-induced hepatocytotoxicity in vitro in normal human hepatocytes », Eur. Rev. Med. Pharmacol. Sci., vol. 21, no 1 Suppl, p. 53‑68, mars 2017.
[66] C. C. Yan et R. J. Huxtable, « Relationship Between Glutathione Concentration and Metabolism of the Pyrrolizidine Alkaloid, Monocrotaline, in the Isolated, Perfused Liver », Toxicol. Appl. Pharmacol., vol. 130, no 1, p. 132‑139, janv. 1995.
[67] O. Mohabbat, M. Shafiq Younos, A. A. Merzad, R. N. Srivastava, G. Ghaos Sediq, et G. N. Aram, « AN OUTBREAK OF HEPATIC VENO-OCCLUSIVE DISEASE IN NORTH-WESTERN AFGHANISTAN », The Lancet, vol. 308, no 7980, p. 269‑271, août 1976.
[68] C. C. J. Culvenor, J. A. Edgar, et L. W. Smith, « Pyrrolizidine alkaloids in honey from Echium plantagineum L. », J. Agric. Food Chem., 1981.
[69] J. O. Dickinson, M. P. Cooke, R. R. King, et P. A. Mohamed, « Milk transfer of pyrrolizidine alkaloids in cattle. », J. Am. Vet. Med. Assoc., vol. 169, no 11, p. 1192‑1196, déc. 1976.
[70] D. E. Goeger, P. R. Cheeke, J. A. Schmitz, et D. R. Buhler, « Effect of feeding milk from goats fed tansy ragwort (Senecio jacobaea) to rats and calves. », Am. J. Vet. Res., vol. 43, no 9, p. 1631‑1633, sept. 1982.
[71] M. L. Deinzer, P. A. Thomson, D. M. Burgett, et D. L. Isaacson, « Pyrrolizidine alkaloids: their occurrence in honey from tansy ragwort (Senecio jacobaea L.) », Science, vol. 195, no 4277, p. 497‑499, févr. 1977.
[72] A. c. Small, W. r. Kelly, A. a. Seawright, A. r. Mattocks, et R. Jukes, « Pyrrolizidine Alkaloidosis in a Two Month Old Foal », J. Vet. Med. Ser. A, vol. 40, no 1‑10, p. 213‑218, févr. 1993.
[73] R. Rasenack, C. Müller, M. Kleinschmidt, J. Rasenack, et H. Wiedenfeld, « Veno-Occlusive Disease in a Fetus Caused by Pyrrolizidine Alkaloids of Food Origin », Fetal Diagn. Ther., vol. 18, no 4, p. 223‑225, 2003.
[74] M. Roulet, R. Laurini, L. Rivier, et A. Calame, « Hepatic veno-occlusive disease in newborn infant of a woman drinking herbal tea », J. Pediatr., vol. 112, no 3, p. 433‑436, mars 1988.
[75] A. Dübecke, G. Beckh, et C. Lüllmann, « Pyrrolizidine alkaloids in honey and bee pollen », Food Addit. Contam. Part Chem. Anal. Control Expo. Risk Assess., vol. 28, no 3, p. 348‑358, mars 2011.
[76] P. M. Ridker, S. Ohkuma, W. V. McDermott, C. Trey, et R. J. Huxtable, « Hepatic Venocclusive Disease Associated With the Consumption of Pyrrolizidine-Containing Dietary Supplements », Gastroenterology, vol. 88, p. 1050‑1054, 1985.
[77] C. F. Weston, B. T. Cooper, J. D. Davies, et D. F. Levine, « Veno-occlusive disease of the liver secondary to ingestion of comfrey. », Br. Med. J. Clin. Res. Ed, vol. 295, no 6591, p. 183, juill. 1987.
[78] S. Györik et H. Stricker, « Severe pulmonary hypertension possibly due to pyrrolizidine alkaloids in polyphytotherapy », Swiss Med. Wkly., vol. 139, no 13‑14, p. 210‑211, avr. 2009.
[79] W. Sperl, H. Stuppner, I. Gassner, W. Judmaier, O. Dietze, et W. Vogel, « Reversible hepatic veno-occlusive disease in an infant after consumption of pyrrolizidine-containing herbal tea », Eur. J. Pediatr., vol. 154, no 2, p. 112‑116, févr. 1995.
[80] C. R. Kumana, M. Ng, H. J. Lin, W. Ko, P. C. Wu, et D. Todd, « Herbal tea induced hepatic veno-occlusive disease: quantification of toxic alkaloid exposure in adults. », Gut, vol. 26, no 1, p. 101‑104, janv. 1985.
[81] B. A. Cook et al., « Hepatic failure secondary to indicine N-oxide toxicity. A Pediatric Oncology Group Study », Cancer, vol. 52, no 1, p. 61‑63, juill. 1983.
[82] « Comfrey/pepsin generic. Price of comfrey/pepsin. Uses, Indications and Description », ndrugs. [En ligne]. Disponible sur: http://www.ndrugs.com/?s=comfrey/pepsin. [Consulté le: 17-juill-2017].
[83] S. R. Dueker, M. W. Lamé, D. Morin, D. W. Wilson, et H. J. Segall, « Guinea pig and rat hepatic microsomal metabolism of monocrotaline. », Drug Metab. Dispos., vol. 20, no 2, p. 275‑280, mars 1992.
[84] C. L. Miranda et al., « Flavin-containing monooxygenase: A major detoxifying enzyme for the pyrrolizidine alkaloid senecionine in guinea pig tissues », Biochem. Biophys. Res. Commun., vol. 178, no 2, p. 546‑552, juill. 1991.
[85] C. C. J. Culvenor et al., « Structure and toxicity of the alkaloids of Russian comfrey (Symphytum x uplandicum Nyman), a medicinal herb and item of human diet », Experientia, vol. 36, no 4, p. 377‑379, avr. 1980.
[86] N. Mei, L. Guo, P. P. Fu, R. H. Heflich, et T. Chen, « Mutagenicity of comfrey (Symphytum Officinale) in rat liver », Br. J. Cancer, vol. 92, no 5, p. 873‑875, févr. 2005.
[87] D. J. Svoboda et J. K. Reddy, « Malignant Tumors in Rats Given Lasiocarpine », Cancer Res., vol. 32, no 5, p. 908‑913, mai 1972.
[88] R. Schoental, M. E. Fowler, et A. Coady, « Islet Cell Tumors of the Pancreas Found in Rats Given Pyrrolizidine Alkaloids from Amsinckia intermedia Fisch and Mey and from Heliotropium supinum L. », Cancer Res., vol. 30, no 8, p. 2127‑2131, août 1970.
[89] O. Robinson et al., « Hirmi Valley liver disease: A disease associated with exposure to pyrrolizidine alkaloids and DDT », J. Hepatol., vol. 60, no 1, p. 96‑102, janv. 2014.
[90] L. S. Gold et al., « A carcinogenic potency database of the standardized results of animal bioassays », Environ. Health Perspect., vol. 58, p. 9‑319, déc. 1984.
Écrire commentaire
Louise (jeudi, 27 juillet 2017 11:52)
Superbe travail d'analyse et de synthèse, Merci !
jean-françois (samedi, 12 août 2017 12:44)
Voilà une saine mise en garde contre les excès de confiance ...
Les cas sont rares mais on ne connait pas le nombre des consommateurs réguliers de consoude.
sylvain (lundi, 14 août 2017 21:15)
Bonjour et bravo pour cet excellent article rigoureux et documenté.
Je déteste le monde moderne !
Nos ancêtres consommaient les jeunes fougères sans se poser de questions... et dans les années 90, la recherche nous a appris que ces jeunes fougères étaient toxiques par bio-accumulation !
Et j'en passe...
Et puis aujourd'hui, j'apprends que la consoude est à classer dans la même catégorie... Genre "à consommer que si on a pas le choix !"
Pendant que l'on apprends que des légumes sauvages immémoriaux ne sont pas aussi anodins que ça, notre terre de France (et d'ailleurs) est inondée par des cocktails chimiques dont l'impact sur la santé est totalement ignoré de par la toute puissance des lobbies de la chimie...
A tel point que je ne récolte rien en plaine...
Et puis au début des années 2.000, une étude a montré que 20% seulement des produits sanitaires pulvérisés sur les betteraves de la Somme arrivaient sur les plantes visées : 80 % étaient transportées ailleurs..., et tombaient sur Paris dans les jours suivant l'épandage...
Ce matin à Ferrals-des-Corbières (11), j'ai croisé un tracteur qui partait pulvériser au niveau d'une équipe qui commençait la vendange...
Et oui, je déteste le monde moderne !
Lorenzi (mardi, 22 mai 2018 14:01)
Pour les personnes qui veulent manger naturel, il ne faut pas traiter les maladies mais enlever les feuilles malades pour éviter la propagation, comme pour la vigne, il y a la cloque et le champignon sur les feuilles, j'enlève beaucoup de feuilles, surtout celles devant les grappes qui les empêchent de mûrir et les "gourmands", les tire-sève etc... Les grappes exposées au soleil sont grosses et bien mûres.
Lorenzi (mardi, 22 mai 2018 14:05)
Pour les fougères, en Asie, les indigènes consomment et vendent le coeur des fougères arborescentes.
Thomas (jeudi, 21 novembre 2019 19:15)
Bon article mais pour moi la conclusion n'est pas bonne. Ce n'est pas logique que la conclusion indique qu'on peut manger plus de grandes feuilles que de petites, les grandes et vieilles feuilles étant en général dans le règne végétal plus chargées en substances nocives que les jeunes feuilles.
L'éveil Sauvage (vendredi, 22 novembre 2019 09:01)
Réponse à Thomas :
Pour la consoude, la concentration en substances toxiques diminue avec l'âge de la feuille. Voilà pourquoi on peut manger plus de vieilles feuilles de consoude que de jeunes. Ce n'est pas un phénomène très rare dans la nature mais c'est vrai qu'il arrive souvent que certaines plantes soient davantage toxiques vieilles que jeunes.
Maxime (jeudi, 23 janvier 2020 10:23)
Bravo pour cet article très complet.
J'ai néanmoins un petit problème. Pour moi la consoude est riche en bore.
Le bore favorise la multiplication cellulaire et le fleurissement. La carence en bore, en particulier en terrains acides, posent des problèmes.
Je n'ai pas fait d'analyse pour connaitre la quantité de bore contenue dans les feuilles de consoude. J'ai fait confiance à toute la littérature unanime (y compris wikipedia).
Ma conviction : le purin de consoude favorise la floraison et le fructification grâce à l'allantoïne et au bore est mise à mal par votre article. Pouvez-vous m'en dire plus. merci
L'éveil Sauvage (samedi, 01 février 2020 17:48)
Bonjour Maxime,
Merci pour votre commentaire. Par rapport à votre question, je n'ai pas la réponse. Mes recherches ne s'était pas concentrée sur le bore et donc je n'en sais pas plus. Bonne journée
Rataud (mardi, 10 mars 2020 21:34)
J'ai vue par le net que le consoude réduisent les fatigue comme arthrose es vrai ? Car j'ai envie de diminuer mes douleur musculaire et articulaire par le consoude !!
Eufricinia (lundi, 04 mai 2020 18:31)
Merci pour cet article si bien travaillé, je suis en train de dessiner une planche botanique sur la Consoude et en faisant des recherches, j'apprends qu'elle est prohibée en Australie! C'est fou comme on veut nous éloigner de notre autonomie et de la nature..
pages odile (jeudi, 03 février 2022 03:07)
bonsoir me voila rassuré pour faire tisanes de feuilles consoude officinale poids 72 kg pour 1m66 age 57 ans car je suis allergique asthme feuilles aprés floraison
Christel (dimanche, 23 avril 2023 15:29)
Bonjour, peut-on utiliser un baume Consoude (symphytum uplandicum Bocking racine) sur le long terme en application sur le visage ? Merci beaucoup pour votre retour ? Existe-il des études et liens fiables et récentes ? Cordialement Christel
Christel (dimanche, 23 avril 2023 15:39)
Réf question baume de Consoude (il s'agit en fait du Symphytum officinale racine et non uplandicum)
L'éveil sauvage (dimanche, 30 avril 2023 16:21)
Bonjour Christel,
Le baume de consoude peut être appliqué sur le visage mais il n'a pas beaucoup d'intérêt et encore moins à long terme car on l'utilise principalement contre les tendinites et les lésions musculaires.
Bonne journée
Cécile (vendredi, 20 octobre 2023 09:19)
Bonjour, merci pour cet article, c'est chouette que des années plus tard il soit consultable. Je suis impressionnée par votre travail de recherche et synthèse, combien de temps cela vous à-t-il pris ?
Merci d'avance
L'éveil sauvage (vendredi, 20 octobre 2023 09:40)
Bonjour Cécile,
À l'époque, j'avais passé environ 3 mois à écrire cet article. Aujourd'hui, je lui vois de nombreux défauts dans l'écriture et la présentation mais l'analyse reste valable.
Bonne journée !
Ella (mardi, 24 octobre 2023 14:50)
Bonjour Aymeric,
Au vu de votre relecture de cet article, est-ce que vous confirmez que les études montrent que la consommation de 10 feuilles de consoude par jour par personne adulte serait sans danger?
Merci de votre retour !
L'éveil sauvage (mercredi, 08 novembre 2023 14:52)
Bonjour Ella,
Oui, cette dose me semble toujours valide tant qu'on parle bien de la consoude officinale (Symphytum officinale) car les autres espèces semblent plus riches en alcaloïdes.
Bonne journée !